
Aşıların içinde grafen oksit ve nanometaller olduğunu bağımsız araştırmacılar sayesinde başından beri biliyoruz, etkilerini de az çok kestiriyorduk. İçerikte adjuvan olarak PEG (polietilen glikol) ve aşı platformu olarak lipid nanopartiküller (LNP ) kullanıldığı ise firmalar tarafından zaten deklare edilmişti.
Burada anlatmak istediğimse, mRNA-LNP’nin insan organizmasında hücrelere girip spike protein ürettirdiği iddiasının da BALON olduğu .
Virüs konusu BALON olduğu gibi, spike protein de bir BALON .
Başından beri böyle olduğunu düşünmekle birlikte, bu kadar çok kanıtı bir araya getirecek zaman olmamıştı. Aylar önce bir tarafa kaydettiğim aşağıdaki şu çalışma, bu düşüncemi kuvvetli bir şekilde destekliyor ve anlamak isteyenler için çok fazla şey ifade ediyor.

GRAFEN OKSİT-LNP, alyuvarlarda ve damarların iç yüzeyini döşeyen endotel hücrelerde DİKENSİ çıkıntılar yapıyor !!!
Grafen oksit (O-GNR) ve PEG-DSPE (polietilen glikol ve polar bir nanolipit olan 1,2-distearoil-sn-glisero-3fosfoetanolamin-N) bir solüsyonda inkübe edilerek kolayca elde edilen bu nonkovalent birliktelik hem amacı karşılıyor hem de spike proteine atfedilen ve klinikte görülen tüm sonuçları açıklıyor.
PEG: Polietilen glikol (polimer bir sentetik hidrojel)
DSPE: Bir çeşit lipit nanopartikül (LNP)
PEGile LNP: PEG eklenmiş LNP
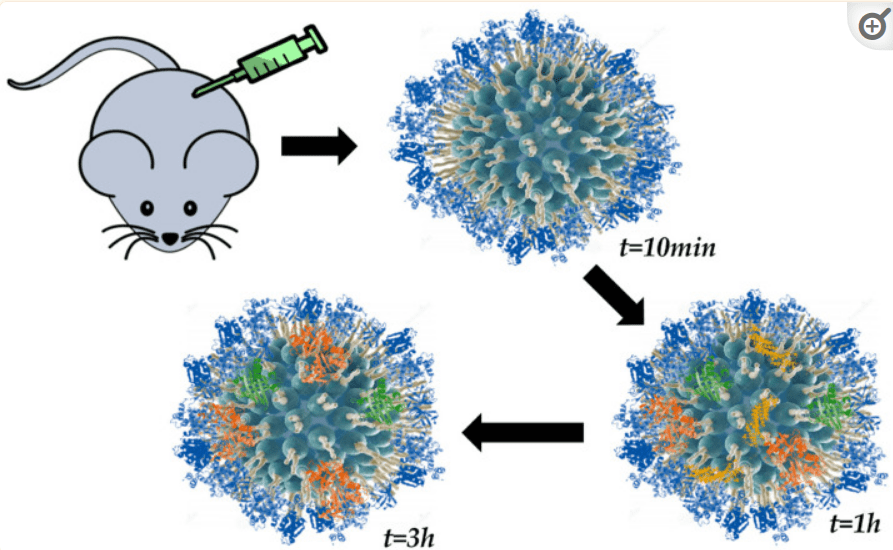
Bu çalışmada EMF ile yönlendirilebilen marifetli molekül grafen nanoşeritlerle –PEGile LNP’lerin dolaşım sistemi ve kan komponentleri ile etkileşimi araştırılmış:
Hepi topu 1-3 ve 12 saatlik laboratuar gözlemleri…
Grafen oksit (O-GNR), dolaşımda çabucak çözüldüğü ve kan proteinleri ile etkileşime girebildiği için dolaşımda dayanıklılığını artırmak amacıyla LNP (PEG-DSPE) ile kaplanmış. Lipid nanopartikul olan DSPE’nin dolaşımda dayanıklılığnın yani dolaşım ömrünün artması için de PEG (polietilen glikol) kullanılmış. Hepsi ayrı ayrı incelemeye değer. Örneğin PEG oldukça allerjen ve kanda pıhtılaşmaya yol açabiliyor. Aynı zamanda kanserojen ve genotoksik olarak biliniyor.
Bu marifetli bileşik (grafen oksit -Pegile LNP), yani (O-GNR-PEG -DSPE) alyuvarlara ve damar endoteline giriyor, iddiaya göre doz bağımlı toksisite yapıyor, ancak inceleme saatlerle sınırlı tutulup laboratuvar şartlarında yapılmış.
Grafen oksit –LNP, alyuvarlarda şekil bozukluğuna dolayısıyla elastikiyet kaybına hatta alyuvar hücre zarında DİKENSİ çıkıntılara, damar duvarlarını kaplayan endotel hücrelerinde yine DİKENSİ çıkıntılara neden olabiliyor. Tanıdık geldi mi?
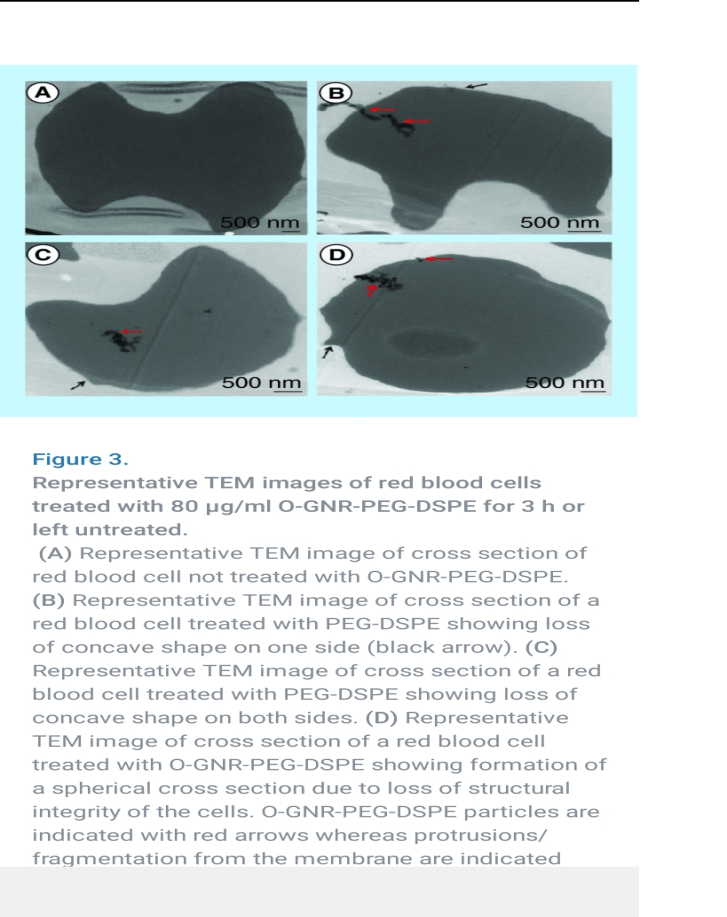

Ayrıca trombositler, bazı kan proteinleri, sitokinler gibi diğer bazı kan bileşenleri ile de etkileşimler gözlenmeye çalışılmış. Örneğin; antiinflamatuar bir sitokin olan IL-10 düzeylerinde yüzde 5-10 azalma izlenmiş (1saatlik izlem). Kabaca O-GNR-PEG-DSPE’nin 80uq/ml altı dozda güvenli olduğu gibi bir sonuca varılmıssa da bu gözlemin bir günden kısa süre için yapılmış olduğu, laboratuvar ortamında kısa bir sürede ISI ve EMF etkileri gibi faktörlerin göz önünde bulundurulmadığına dikkat çekmek isterim.
Şimdi bu süreçte sıkça duyduğumuz bazı kavramlara da özetle değinerek konuyu daha iyi anlamaya çalışalım.
Nanopartikül ya da nanoparçaçık, bir maddenin boyutları 100 nm ve altında kalan toz parçalarına verilen addır.
Nanotıp nasıl tanımlanıyor bakın:
Nanoboyutlarda işlenmiş alet ve cihazları kullanarak insan biyolojisi ve sağlığının moleküler düzeyde incelenmesi, tedavisi, yeniden yapılanması ve kontrolü.
Nanomateryaller büyük parçacıklara göre daha yüksek yüzey/hacim oranına sahiptirler. Bu avantajla kan beyin bariyerini geçebilir, diş minesinden saç teline kadar hücrelerin içine girebilirler. Bu nedenle nanopartiküllerin biyomedikal alanda ilaç taşınması-salınımı ve görüntülemede kullanımı gibi uygulamaları son yıllarda iyice yaygınlaşmıştır. Ancak her yere girebilecek kadar küçük olmaları biyolojik sistemde işlerin tam da böyle olacağı anlamına gelmiyor tabii. Malzeme boyutu küçüldükçe yüzeyde bulunan atom miktarı artmakta ve buna bağlı olarak da malzemenın çevre ile etkileşimi değişmektedir. Bizi ilgilendiren ise bu çevre ‘insan vücudu’ olduğunda neler olduğudur. İlginç bir şekilde nanopartiküller, makro eşdeğerlerine göre daha güçlü özellikler gösterebildikleri gibi tamamen farklı özellikler de gösterebiliyorlar. Nano boyuttaki malzemeler daha yüksek reaktiflik ve mekanik direnç, daha iyi elektriksel ve termal özellikler gösteriyorlar Nanotıpla birlikte insanların nanopartiküllere maruz kalması kaçınılmaz görünüyor. Bununla birlikte nanoparçaçık türlerinin ve uygulamalarının sayısı artmaya devam ederken, maruz kaldıktan sonra etkilerini karekterize etmeye ve potansiyel toksisitelerini anlamaya yönelik çalışmalar kıyasla az görünüyor.
Raporlar nanopartiküllerin kan proteinleri, pıhtılaşma faktörleri, kan hücreleri, vücut savunma sistemi ve allerji yanıt sistemi bileşenleri ile etkileşime girmesinin ne kadar mümkün olduğunu göstermektedir. Tüm canlı sistemi tüm olasılıklarıyla incelemenin zorlukları düşünüldüğünde, nanoparçacıkların hematolojik toksisitesi genel toksikolojik değerlendirmesinin çok kritik bir bileşenidir. Araştırmalar nanoparçacıkla indüklenen hematolojik toksisitenin tezahürünün değişebileceğini ve artmış veya azalmış hücre sayıları (kırmızı ve beyaz kan hücreleri), vücut savunma sisteminin aktivasyonunu veya inhibisyonunu, hemolizi, endotel disfonksiyonu ve allerjik tepkileri içerebileceğini düşündürmektedir. Nanoparçacıkların eritrositlerle etkileşiminin hücre zarında penetrasyona neden olduğu ve hemolize (alyuvarların büyük miktarda yıkımı ) yol açan hücre iskeleti bozulması yanı sıra eritrositleri deforme ettiği gösterilmiştir. Örn; altın nanopartikuller alyuvar ve kan hücresi sayısında artış veya azalmaya yol açıyor. Demir oksit, titanyum dioksit, silika gibi nanopartikuller enflamasyona ve endotel disfonksiyonuna yol açıyor, çinko oksit bağışıklık tepkisini aktive ediyor.
Lipit nanopartiküllere (LNP’ler) gelince, enjekte edildikleri doku bölgesinde en çok olmak üzere yüksek inflamatuar (iltihabı ) yanıt oluşturuyor ve antikor üretimine neden oluyorlar. Yani mRNA olmadan ve sözde spike protein üretilmeden de yüksek inflamatuar etki ve antikor oluşumuna neden oluyorlar.
LNP’ler örneğin intranazal (burun içi) olarak uygulandığında akciğerlerde ciddi tahribat yapıyor. Buraya değinmişken ısrarla intranazal (burun içi) aşı isteyen-öneren sözde muhalif profesörü hatırlamadan geçmeyelim.

Burada bu yüksek inflamatuar yanıt sanki iyi bir şeymiş gibi verilmek istense de, gerçeğin böyle olmadığını anlamak için ortalama bir zeka yeterlidir sanırım. İşte LNP ve PEG’ler, bildirilen aşı etken maddesi olmaksızın da bol miktarda antikor yanıtı oluşturuyor.
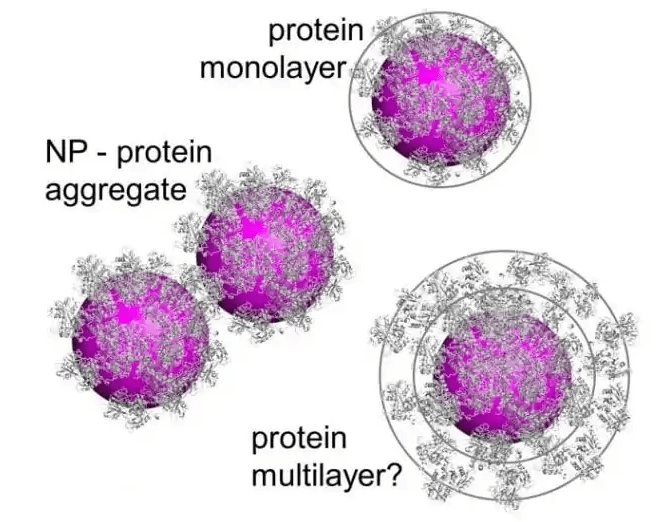
Nanomalzemeler biyolojik bir ortamla temas ettiğinde, ortamda bulunan biyomoleküllerle, özellikle proteinlerle etkileşime girme eğilimindedir ve bu etkileşim ‘’protein KORONA’’ (PC) oluşumuna yol açar ve aynı zamanda bu proteinlerde yapısal değişikliklere neden olabilir. Bu değişiklikler sadece NP fizikokimyasal özelliklerine değil, aynı zamanda protein moleküllerinin içsel stabilitesine de bağlıdır. NP’lerin yüzeyinde protein korona oluşumu ve altta yatan mekanizmalar çeşitli çalışmalarda araştırılmış olsa da, NP’ler ve kan proteinleri arasındaki doğrudan biyokimyasal ve biyofiziksel etkileşimleri hiçbir inceleme kapsamlı olarak tartışmamıştır ve in vivo (canlının içinde) araştırmalar çok azdır. PC’yı karakterize etmeye çalışan çalışmalar çoğunlukla in vitro (laboratuar ortamında-yapay) olarak yapılmıştır.
Örnek bir araştırmada Altın nanopartiküller (AuNP’ler) etrafında 300’den fazla farklı faktör tanımlanmıştır. AuNP’lerin çevresinde yaklaşık 288 serum proteini saptanmış ve ilginç bir şekilde PC bileşenlerinin %93’ünün 80 protein tarafından üretildiği görülmüş. PC bileşimlerinin %87’si anti-trombin III, kompleman C3, faktör V, fibronektin, IgG ve kompleman faktörü H’dir. NP’lerin boyutu, yüzey kimyası, şekli ve entropisi, plazma protein adsorpsiyonunda ve dolayısıyla biyolojik dağılım kapasitesinde en önemli parametrelerdir. Biyolojik numuneler içinde, benzer yüzey kimyası ve kompozisyona ancak farklı boyutlara sahip NP’lerin inkübasyonu, çapı 30 ila 200 nm arasında değişen PC oluşumuna katkıda bulunabilir. Dikkate değer bir şekilde, yüzey bileşimindeki değişiklik, NP’ler etrafındaki PC içeriğini derinden değiştirebilir. Bu, birçok bilinmeyen parametrenin etkisinden dolayı PC fenomeninde ortak bir kuralın bulunmasının pek mümkün olmadığı anlamına gelir. Diğer bir deyişle, NP’lerin yüzeyinin küçük moleküller, peptitler, aptamerler, proteinler, antikorlar vb. herhangi bir ligand türü ile süslenmesinde yoğunluk, moleküler ağırlık, zincir uzunluğu vb. diğer parametreler açısından ayrıntılı olarak ele alınmalıdır.
PC oluşumu uygulama yolunun (intravenöz, oral ve inhalasyon) rolü de PC’nin bileşimi ve profilinde kritik öneme sahiptir. PC içeriğindeki herhangi bir değişiklik doğrudan kan akış hızı, laminer/laminer olmayan kan akışı, cinsiyet ve sıcaklık gibi çevresel özelliklerle ilişkilidir. PC’nin, özellikle yumuşak korona tabakasının stabilitesinin, kılcal damarlardan arterlere kan akış hızı gibi çevresel özelliklere bağlı olarak değiştirilebileceği bulunmuştur. NP’ler dolaşımda 1000 kadar farklı proteinle karşı karşıya gelir. Çeşitli proteinlerin yüzen NP’lere bağlanması, sonuç olarak in vivo koşullarda biyolojik aktiviteyi etkileyen farklı NP alt popülasyonlarının oluşumuna yol açabilir. İlginç bir şekilde, her bir patolojik durumun belirli proteomik profili, spesifik NP’ler etrafındaki PC içeriğini etkileyen başka bir tartışılmaz faktördür. Şaşırtıcı bir şekilde, bu profil aynı durumda (sağlıklı veya hasta kişilerde) bireysel olarak farklılık gösterir.
Yani, biyolojik sisteme giren bir nanopartikülün farmakolojik davranışını değiştirip etkileyecek çok sayıda değişken bulunuyor.

Nanopartikül deyince eksozomlar da virüsler (virüsü eksozomlardan ayırdedici gerçek bilimsel kanıt yok, çünkü saf bir izolat olmadığı gibi kontrollü bir deney de yok) de benzer nano boyutlarda ve bunlar da dolaşıma girince aynı şekilde etraflarında protein korona oluşuyor. Eksozomların zarı, kaynaklandıkları hücre duvarından oluşuyor, zarflı virüslerin zarfı da konak hücre zarından oluşuyor.
Eksozomlar kaynaklandıkları hücreye, koşullara ve içlerinde taşıdıkları nükleik asit vs. içeriğe göre çok çeşitlidir, virüsler de !?
Elektron mikroskopisi resimleri de protein korona ile şematize edilişleri de ne çok benzer, değil mi?
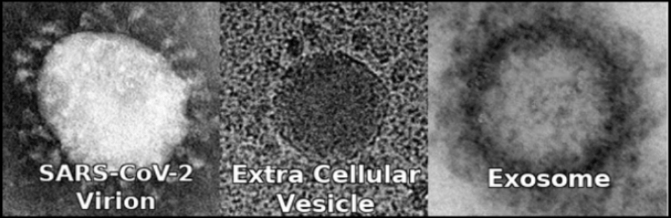
Benzerlikler bu kadarla sınırlı değil tabii ki. Klasik virüs izolasyonu modaliteleri ile eksosom izolosyonu modalitelerinin karşılaştırması yapılırsa her ikisinin de saf bir izolat sağlamadığı, parçalanmış hücrelerin benzer yoğunlukta diğer hücre içerikleri ile karışmış olduğu ve virüs izolasyonu için kontrol deneyleri yapılmış olsa—ki hiç yapılmamış—elde edilecek olanın aynı olacağı izlenimini edinmek mümkün. Ki eskiden virolog olan ve şimdi ise virüslerin gerçekte eksozomlardan başka bir şey olmadığını tespit ederek bu ‘’virolog’’ sıfatını artık kullanmayan Dr. Stefan Lanka, kontrol deneyi yapıldığında, yani izolasyon prosedürü hasta örneği kullanmadan uygulandığında görülenlerin aynı olduğunu, çünkü bu yapıların virüs değil eksozom olduğunu anlatıyor. Ve artık virüs izolasyonu olarak adlandırdıkları klasik prosedürlerin yerine antikor işaretleme gibi dolaylı yöntemler kullanılıyor. Virüs genom veri tabanlarında yüz bine yakın farklı virüsün genom dizileri bulunduğu iddia ediliyor. Virüsler için genetik modifikasyonla işlev kazandırma çalışmaları yapıldığı iddia edildiği gibi eksozomlar için de aynı şekilde genetik modifikasyon çalışmaları yapılıyor.
Eksozomlar, çeşitli hücre tiplerinden salınan hücre dışı (ekstrasellüler) veziküllerin (EV’ler) bir alt sınıfıdır ve hücreler arasındaki parakrin (bir hücreden salınan hormonun komşu hücre reseptörlerine bağlanarak etki göstermesi) etkileşime katılırlar. 30-100 nm arasında değişen boyutlarıyla eksozomlar zardan türetilmiş nanoveziküllerdir. Tüm hücre tipleri tarafından endozomlardan üretilirler. Hipoksi, inflamasyon stimülasyonu ve hücre içi kalsiyum konsantrasyonunun artmasının hücreleri daha fazla eksozom üretmeye zorladığı güçlü bir şekilde gösterilmiş bulunmakta. Eksozomlar, biyoakışkanlarda kolayca dağılarak, yüklerini ileterek, paylaşarak ve alıcı hücrelerin biyolojik özelliklerini değiştirerek hücre-hücre iletişiminin aracıları olarak hizmet edebilir ve proteinler, lipitler ve nükleik asitler gibi sinyal biyomoleküllerini donör hücrelerden alıcı hücrelere aktarabilir. Bu ifadeler doğrultusunda, eksozomların fizyolojik ve patolojik koşullar sırasında biyokimyasal reaksiyonları ve hücresel aktiviteyi modüle etmek için KİLİT aracılar olduğu düşünülmektedir. Eksozomların yüzey proteinleri ve içerdikleri nükleik asit profiller çift sarmallı DNA, mRNA ve mikro-RNA’lar gibi çeşitlidir. Bunlar, kaynak hücrelerin tipleriyle ve ayrıca iltihaplanma, kanser, nörodejeneratif durum gibi hücre durumlarıyla ilişkilidir.
Son on yılda, hücre dışı veziküllerin (EV’ler), özellikle eksozomların incelenmesi, benzersiz biyolojik özelliklerinden dolayı özellikle kanser ve doku rejenerasyonu alanlarında hücre hedefli ilaç taşıma sistemi olarak kullanım için ilgi çekmiştir. Endojen eksozomların çekici biyolojik özellikleri ve işlevleri hem bilimsel hem klinik alanda daha fazla araştırmaya ilham veriyor.
Eksozomlar çevredeki vücut sıvılarına salınır. Ana hücrelerin (proteinler, DNA, RNA, lipitler gibi) moleküler imzalarını içerirler. Başka hücrelere alımı için tanınmayı sağlayan yüzey proteinleri ya da makrofajlardan korunmayı sağlayan protein yapıları vardır. Eksozomlar, en ilginç invaziv olmayan tanısal biyobelirteç ve terapotiklerdir. Düşük immünojenisite, doğal stabilite ve biyolojik engelleri aşma yeteneği dahil olmak üzere içsel özellikleri göz önüne alındığında eksozomların fonksiyonel kargo teslimatı için terapotik araçlar olarak kullanılması planlanmış ve bunun için eksozomlar çeşitli hücre hedefli tedavilere uygun hale getirmek için ilaçlarla kapsüllenmiştir.
Eksozomları, benzer bir lipit çift katmanlı yapıya sahip yapay veziküller olan lipozomlarla ve diğer nanotaşıyıcılarla karşılaştırdığımızda, biyolojik moleküllerin gelişmiş yükleme kapasitesi, alıcı hücrelere girme, uyumluluk, kararlılık, doğal biyoaktivite açısından üstündür. Bundan, eksozomların sadece ilaçları taşımakla kalmayıp aynı zamanda yarı ömürlerini artırdığı, toksisiteyi azalttığı ve hatta çeşitli engelleri aştığı sonucuna varabiliriz. Ancak düşük izolasyon verimi ve yetersiz hedefleme yetenekleri terapötik uygulanabilirliğini sınırlar. Çok miktarda izole edilmesi güç ve maliyetli olduğundan ilaç taşıma sistemleri olarak henüz kullanışlı olmadıkları anlaşılıyor. Bu sıkıntı eksozom-mimetik (eksozom taklitçi ) nanoveziküler taşıma sistemleri kullanılarak çözülmek isteniyor. Lipozomlar, üzerinde en çok çalışılan nanosistem türleridir ve yaygın olarak kullanılmaktadır. Lipozomol vitaminler gibi…
Son zamanlarda çalışmalarda bu ekstraseüllüler veziküllerin hedefleme yeteneğini geliştirmek için manyetik navigasyonlu süperparamanyetik demir oksit nanoparçacıkları (SPION’lar) kullanılmış. (FDA onayı almış olan ilk nanometal.)
Anlaşılan özellikle grafen oksit ve süperparamanyetik demir oksit gibi manyetik nanometaller, eksozomlar gibi nanoboyutta oluşlarıyla ve bu nanoyapıları manyetik etkiyle hücresel tedavi hedefi için dikkatleri çekiyor. Alttaki linkte SPION’larla birlikte bu nanoveziküllerin hücre içinde magnetik alandan nasıl etkilendiğini anlatıyor ve şematize ediyor.

Dolaşımda 1000’e yakın protein ve lipit çeşidi bulunuyor. Ve bir nanopartikül ortalama 300 çeşit proteinle kaplanarak olduğundan çok daha büyük ve farklı bir kimliğe bürünüyor. Bu protein KORONA oluşumu, nanopartikülün hedefine ulaşamadan dolaşımdan hızla temizlenmesine ya da taşınmak istenen ligandın başka bir noktada serbest kalmasına ya da karaciğerde tutulmasına, metabolize olmasına neden olabilir. İşte bu protein KORONAyı oluşturan proteinleri azaltmak ve dolayısıyla bu olasılıkları azaltıp NP (nanopartkül)-ligand (ilaç ya da gen gibi) bileşiminin dolaşımda dayanıklılığını arttırmak için nanopartiküllerden başka bir ilaç taşıma sistemi olan hidrojeller de kullanılıyor.
Aşağıdaki şekilde bir hidrojel olan PEG (polietilen glikol) ile nanopartiküllerin bileşimi, yani NP’in PEGilasyonu, NP’ler ile proteinler arasındaki etkileşimi en aza indirerek daha küçük bir protein koronası oluşumuna yol açar. Çalışmalar PEG ile muamelenin NP’lerin dolaşımda makrofajlar tarafından eliminasyonunu azalttığını gösteriyor.
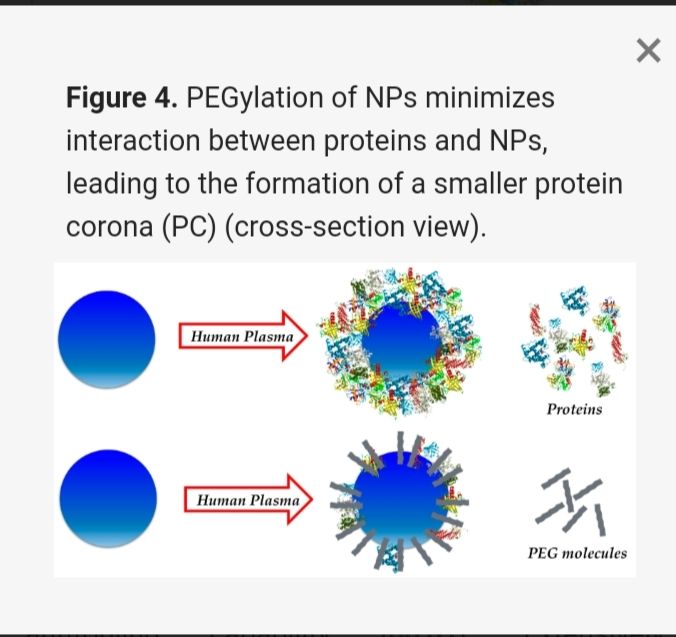
Protein Koronası şematize edilişi ne kadar da tanıdık, değil mi?
İşte bu protein korona tüm nanoparçaçıklar ve doğal nanoveziküller olan eksozomlar veya virüsler etrafında da oluşuyor.
Lipid nanopartiküller gibi bir başka ilaç taşıyıcı sistemi de HİDROJELler. İyi emilimleri, iyi biyouyumlulukları ve en azından doğal olanların yüksek güvenlikleri nedeniyle hidrojeller, ilaç iletimi ve doku rejenerasyonu da dahil olmak üzere biyotıp alanında yaygın olarak kullanılmaktadır.
Hidrojel bazlı sürekli salınımlı ilaç taşıyıcıları gelişmekte olan bir ilaç dağıtım sistemidir. Hidrojel hazırlamak için kullanılan malzemeler doğal ve sentetik olarak ikiye ayrılabilir. Selülöz, kollajen gibi doğal olanlar yanında polivinil alkol, poliakrilamid, polietilen glikol gibi sentetik hidrojeller daha çok tercih ediliyor. Sentetik bir polimer olan PEG (polietilen glikol) ise yakın zamanlarda en yaygın olarak kullanılanlarıdır. PEG türevlerinin lipozomlara dahil edilmesi lipozomların serum proteini ve makrofajlarla etkileşimlerini azaltıyor gibi görünüyor. Bazı yayınlar birleştiği proteine göre karakterinin değiştiğini, aslında yüksek biyouyumlu olduğunu iddia etse de PEG oldukça allerjen ve grafen gibi kanın pıhtılaşmasına neden olabilen, hipersensitivite ve allerjik reaksiyonlara, antikor yanıtına yol açabilen bir hidrojel.
Grafen ailesi nanomateryallere gelince;
Eşşiz fizikokimyasal özelliklerinden dolayı grafen ailesi nanomateryaller (GFN’ler) grafenin yüksek mekanik dayanıklılık ve elektrik iletkenlik dahil bir dizi potansiyel fiziksel ve elektronik özelliklerinden dolayı dikkat çekmekte, özellikle biyomedikal uygulamalar olmak üzere birçok alanda yaygın olarak kullanılmakta ve araştırmaların burada yoğunlaştığı görülmektedir. Örneğin, kök hücrelerin farklılaşmasına etki etmek üzere yapılan çok sayıda çalışma dikkatleri çekiyor.
Grafen oksit = grafen nanoşeritler
CNT (Karbon nanotüp ) = İçi boş tüpler oluşturmak üzere sarılmış grafen tabakalarından yapılan silindirik şekilli nanoyapılar
Lipozom: En az bir çift katlı lipit tabakasına sahip küre şeklinde nanoboyutta ve yapay bir veziküldür. (ilaç taşımak için kullanılan bir çeşit küresel nanolipit)
Grafen nanoparçacıklar biyosensörlerin bileşenleri olarak veya hücreyi UZAKTAN KONTROL etmek için kapsamlı bir şekilde araştırılmış. Araştırmalar CNT/protein hibritlerin biyolojik yapı iskeleleri oluşturarak terapötik ve görüntüleme materyalleri olarak hizmet edebileceğini gösteriyor. Asıl dikkat çekici olansa, CNT’lerin tıpkı nöronların myelin klıfı gibi işlev görmesi ve sinirlerin CNT’lerle arayüz oluşturması. Yapılan çalışmalara bakınca nanopartiküller içinde üzerinde en çok durulan en populer olanların grafen bazlı olanlar olduğu çok açık. Bu çok duvarlı karbon nanotüplerin (CNT’lerin) oksidatif açılmasıyla sentezlenen grafen nanoşeritler (O-GNR) de son zamanlarda biyogörüntüleme ve ilaç verme uygulamaları için umut vaat ediyor gibi görünmekte ya da öyle gösterilmekte. Çünkü bunlar, oldukça toksik materyaller. Aşağıdaki bağlantı da grafen ailesi nanopartüküllerin toksisitesi ile ilgili fikir verecektir.

Bu süreçte bir çok bağımsız araştırmacı, Sinovac dahil tüm sözde covid aşılarının içeriğinde grafen nanoseritleri ve CNT’leri ve bazı nanometalleri görüntülediler ve Dr Karen Kingston (Pfizer eski biyoanalisti) gibi uzmanlar belgelerle, kanıtlarıyla aşılarda grafen oksit olduğunu bildirdiler. Karen Kingston bu uygulamayı yapanların asıl amaçlarının grafen için uygun dozu bulmak olduğunu söylüyordu. Ne için en uygun doz ???
Hatırlarsanız Japonya Sağlık Bakanlığı’nın Moderna aşısında nanometal tespiti üzerine aşıları toplattığı haberleri olmuştu. Mıknatıslanma özelliği görülünce kontaminasyon olduğu sanılmıştı, oysa bu nanomettaller tam da planın gereği olarak orada bulunuyor gibi görünüyor. Birçok araştırma incelendiğinde, diğer nanometallerin de daha çok grafen oksitle etkileşim ve etkinliğini artırmak için kullanıldığı izlenimini edinmek mümkün. Ayrıca farklı nanometaller grafen oksitle (karbon bazlı yapıştırıcı) bir arada tutularak dolaşımda agregatlar oluşturuyor. (Hepsi de toksik.)
mRNA-LNP aşı iceriğinde karbon nanotüpleri ilk tespit eden, çocukluk aşılarına karşı mücadelesiyle bilinen Dr Palevsky ve arkadaşları olmuştu. Grafen hakkında araştırma raporlarının iddiası CNT’lerin (karbon nanotüplerin), ilaç ve aşıları yani burada mRNA’yı hücre içine iletmek için kullanıldığı yönünde.
Özetle; LNP, mRNA’nın (ya da grafen oksitin) dolaşımda yıkılmasını önleyip dolaşım ömrünü uzatmak ve hedef hücrelere ulaştırmak, polietilen glikol (PEG) ise LNP’nin proteinlerle etkileşimini azaltıp kolayca yıkılmasını önlemek ve dolaşım süresini uzatmak için kullanılıyor.
Protein sentezi hakkında klasik öğreti; mRNA, bir DNA kalıptan transkripsiyon yoluyla (yani DNA’yı kalıp olarak kullanarak) hücre çekirdeğinde sentezlenir ve protein sentez yeri olan ribozomlara (hücre stoplazmasına çıkarak) protein kodlayıcı bilgiyi taşır.
Şimdi gözümüzün önüne getirelim;
Nanoboyutta mRNA, grafen nanokafeslerle sarılıyor, bu da LNP ile kaplanıyor; o da PEG ile. Sonra bu müthiş birliktelik dolaşımdan hücrelere CNT’lerin oluşturduğu kanallardan ya da endositoz gibi doğal yollardan girip hücre stoplazmasında mRNA açığa çıkıyor, bu da hücrelerde spike protein sentezlettiriyor!?
Bu nanoparçaçık bileşimlerinin biyolojik sistemde davranışının ne kadar çok değişkenden etkileneğini, in vivo çalışmaların yetersizliğini ve hücre altı olayların büyük oranda karanlıkta kaldığını düşünürsek, en azından son basamak pek mümkün görünmüyor. Bu yazıyı hazırlarken, tam da zamanında sanki bir lütuf olarak bulduğum şu sayfa ise anlatmak istediklerimi derli toplu kanıtlar nitelikte:
Burada araştırmacılar aşılar içinde asıl unsurun Grafen oksit ve PEGile LNP olduğunu, bunun dışında pek çok nanometal, hatta parazit olduğunu ancak minimum düzeyde mRNA tespit edildiğini (O da olur ya aşılar bir gün incelenirse ‘mRNA hiç yoktu ‘denemesin, virüs ve spike protein yalanına uyanılamasın ve toksisiteyi asıl yapanın O-GNR ve diğer unsurlar olduğu anlaşılmasın, diyedir herhalde) belirtiyorlar.


Grafen oksitle yüzde yüz dolu lipozomlar, çeşitli nanometal ve grafen oksit kümeleri izlemişler. Ayrıca dolaşımda simplast olarak tanımladıkları birçok hücrenin veya amibin (tek hücreli parazit) kaynaşarak bir araya getirdikleri dolaşım için büyük denebilecek boyutta kütleler de tespit edilmiş.
Özetle;
Kanın viskozitesini (kanın akışkanlığını ) etkileyen başlıca faktörler kan hücrelerinin sayısı, kan proteinleri ve kan hücrelerinin elastikiyeti yani şekil değiştirebilirliği olduğuna göre, dolaşımda kan hücrelerinde çıkıntı yapabilen, hücre zarlarının elastikiyetini azaltıp alyuvarların şeklini bozan ayrıca kan proteinlerini üzerinde toplayıp aralarındaki ilişkileri ve yapılarını etkileyen nanopartiküllerin genel anlamda hiperviskoziteye dolayısıyla dolaşım sorunlarına, dokularda oksijenlenmenin bozulmasına neden olacağı açıktır.
In vivo çalışmaların yetersizliği göz önüne alındığında sadece dolaşım sistemi değil tüm sistemin çok çeşitli koşullarda, farklı şekillerde ve farklı zamanlarda etkileneceğini anlamak güç değildir. Hasta ya da sağlıklı kişilerin hatta hastalığın tipine, yerine göre de farklı etkilenebileceği, farklı ph düzeyleri, oksijenlenme durumuna göre ya da aşı dozları ve içeriklerine (bir kısmının da plasebo olduğunu unutmayalım), dolaşımda karşılaşılan proteinlerin durumuna göre farklı düzeylerde ve farklı zamanlarda etkilenme mümkün olacaktır. Bu rastlantısallık ve çeşitlilik, bildirilen yüzlerce kötü sonucun çeşitliliğini de açıklar niteliktedir.
